El fluido eléctrico y el electrón como unidad de electricidad
- El descubrimiento de la electricidad se suele atribuir a W. Gilbert, físico y médico de la reina Isabel I de Inglaterra, por un estudio científico sobre los fenómenos eléctricos que realizó hacia el año 1600, en el que por primera vez se aplicó el término «eléctrico» a la fuerza que ejercen algunas substancias al ser frotadas, las cuales clasificó llamando cuerpos eléctricos a las no ejercían atracción alguna (hoy aislantes) y aneléctricos (hoy conductores) a las que sí atraían otros objetos. B. Franklin, en el s. XVIII, retomó su idea de que la electricidad era un fluido que pasaba de unos cuerpos a otros al ser frotados, afirmando la electricidad como un fluido único existente en toda materia: los cuerpos que ganaban (perdían) ese fluido adquirían electricidad positiva (negativa), calificándolos de eléctricamente positivos (negativos por defecto de ese fluido).
- En 1800 A. Volta inventó la primera pila, precursora de la batería eléctrica; en 1813 Oersted predijo la existencia de los fenómenos electromagnéticos y en 1820 estableció la capacidad de desviar agujas imantadas; en 1821 Faraday descubrió la inducción electromagnética y en 1826 Ampère estableció sus leyes.
- Los experimentos de M. Faraday sobre electrólisis, con la formulación de sus leyes en 1833, evidenciaron una asociación entre la carga eléctrica y la estructura atómica. Dichas leyes pueden resumirse en la fórmula
, donde
es la masa de un compuesto dado, liberada en un electrodo cuando se hace pasar una corriente de carga eléctrica
a través de una disolución electrolítica (conductora);
es la constante de Faraday,
representa el peso equivalente de la sustancia, o peso atómico, o molecular, dividido por la valencia
(1 Faraday culombios libera 1,008 gramos de hidrógeno, 8 gramos de oxígeno, etc. ).
- Faraday interpretó sus resultados suponiendo que una cantidad dada de electricidad era acarreada por cada átomo (o grupo de), denominándolos «iones»; en la electrólisis, la corriente eléctrica se producía al desplazarse estos iones a través de la disolución, los cationes (carga positiva) hacia el cátodo y los aniones (carga negativa) hacia el ánodo. Estos resultados implicaban la existencia de una unidad elemental de electricidad, de la cual algunos iones llevarían una unidad, otros dos… (nota: esta unidad valdría, según lo dicho,
, pero no se dispondría de estimaciones de
hasta 1865). Pero la idea de que la carga eléctrica existiese en unidades discretas contradecía otras evidencias experimentales, como las asociadas a la conducción metálica, y el mismo Faraday fue reacio a aceptarla.
- En 1874 C.I. Stoney propuso tomar como unidad natural de electricidad la cantidad de electricidad que debe hacerse pasar a través de una solución electrolítica para liberar un átomo de una sustancia monovalente, denominándola en 1891 como «electrón», antiguo nombre para una aleación de oro y plata de aspecto parecido al ámbar (resina pétrea denominada «elektron»,
en griego, en la que Thales allá por 600 a.C. observó la propiedad de atraer pequeños objetos después de ser frotada). Stoney sería el primero en estimar
, usando el valor de
calculado por J. Loschmidt en 1865.
- Curiosidad: Para hacerse una idea de cuáles eran los conocimientos sobre electricidad en 1907, pueden leerse los siguientes extractos del manual «Elementos de Física», de Eduardo Lozano y Ponce de León, Catedrático de Acústica y Óptica en la Universidad Central de Barcelona:
http://www.xtec.cat/~cgarci38/ceta/historia1/volta.htm (una lectura deliciosa, por cierto). - Otra referencia histórica: La Historia de la electricidad, descubrimiento a descubrimiento en sus autores: http://tochtli.fisica.uson.mx/electro/historia.htm
Tubos de descarga y rayos catódicos: el electrón como partícula
- Una página sobre los tubos de rayos catódicos: http://www.crtsite.com/page7.html y una Galería de tubos de Crookes.
- Los tubos de descarga enseñados en 1907: otro extracto del manual «Elementos de Física», de Eduardo Lozano y Ponce de León, Catedrático de Acústica y Óptica en la Universidad Central de Barcelona:
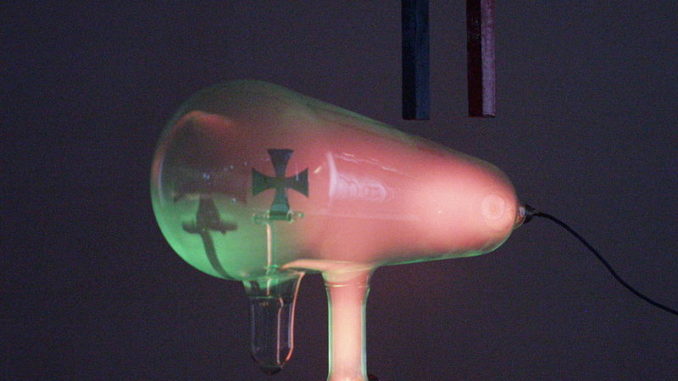
http://www.xtec.cat/~cgarci38/ceta/historia1/fenoelec.htm - Un «tubo de Crookes» es un tubo de descarga eléctrica experimental, con vacío parcial, inventado y por el físico inglés W. Crookes y colaboradores a lo largo de 1869-1875. Desarrollado a partir de un modelo anterior de Geissler, consta de un recipiente de vidrio parcialmente evacuado (esto es, conteniendo gas rarificado o a baja presión) de diversas formas, con dos electrodos de metal, el cátodo y el ánodo, cada uno en un extremo. Cuando se aplica un alto voltaje entre los electrodos, los denominados rayos catódicos se propagan desde el cátodo al ánodo:
- El estudio de la conductividad de los gases realizado a lo largo del s. XIX propició una tanda de nuevos descubrimientos que revolucionarían la física, siendo el primero de ellos el de los rayos catódicos. El hecho es que a presión ordinaria los gases no conducían la corriente eléctrica, pero si se extraía gas del tubo aparecían una serie de nuevos fenómenos: cuando la presión era de unos 5 mm de Hg, el tubo emitía luz cuyo color dependía del gas que llenara el tubo; a 0,1 mm de Hg aparecían franjas luminosas y oscuras; cuando la presión era ya de tan sólo 0,001 mm de Hg, una resplandor amarillo-verdoso aparecía en la zona del tubo opuesta al cátodo, tras el ánodo.
- En 1858 J. Plücker estudió la conducción de electricidad a través de gases a muy baja presión utilizando un tubo de vidrio en el que colocó dos placas metálicas en la parte interior de los extremos, observando que todo el tubo se iluminaba al aplicar electricidad a las placas, mientras que, cuando se había conseguido suficiente vacío en el tubo, la luz desaparecía, quedando tan sólo un resplandor verdoso en el vidrio cercano a la zona de la placa conectada al ánodo. Parecía que la luminosidad en esa zona era producida por algún tipo de rayos emitidos por la placa conectada al cátodo, que viajaban de una placa a la otra a través del vacío, y también se observó que la posición de la imagen luminosa podía ser modificada si se acercaba un imán a la zona del ánodo. Su alumno J. W. Hittorf encontró que al interponer objetos entre el cátodo y el ánodo se producían sombras en la imagen luminosa, reforzando la idea del origen catódico para esos rayos, que serían luego, en 1876, denominados como «rayos catódicos» por E. Goldstein, quien demostró además que las propiedades de esos rayos no dependían del material de que estuviera hecho el cátodo y que el brillo producido aumentaba cuando se disminuía la presión del gas. Durante la década de los 1870, W. Crookes desarrolló el primer tubo de rayos catódicos con un vacío elevado (vacío con presión en el rango de 100 mPa a 100 nPa,
), estableciendo definitivamente que esos rayos luminiscentes que aparecían dentro del tubo llevaban energía e iban del cátodo al ánodo; además, aplicando un campo magnético, fue capaz de desviar los rayos, confirmando que el haz se comportaba como si estuviera cargado negativamente; en 1879 propuso que estas propiedades se podían explicar con lo que él denominó «materia radiante», sugiriendo que se trataba del cuarto estado de la materia, que consistía en moléculas cargadas negativamente que eran proyectadas a alta velocidad desde el cátodo. A. Schuster continuó los experimentos iniciados por Crookes colocando placas de metal paralelas a los rayos catódicos y aplicando un potencial eléctrico entre ellas; el campo desviaba los rayos hacia la placa cargada positivamente, lo que reforzaba la hipótesis de que los rayos llevaban una carga negativa. En 1890, al medir la cantidad de desviación causada por un cierto nivel de corriente eléctrica, Schuster estimó la proporción masa-carga de los componentes de los rayos. En 1895, el físico francés J. B. Perrin encontró que los rayos catódicos depositaban carga en un electroscopio, con lo que confirmó definitivamente que se trataba de partículas cargadas. (Fuentes principales resumidas para del párrafo: http://bibliotecadigital.ilce.edu.mx/ sites/ciencia/volumen2/ciencia3/068/htm/sec_6.htm ; https://es.wikipedia.org/wiki/Electr%C3%B3n).
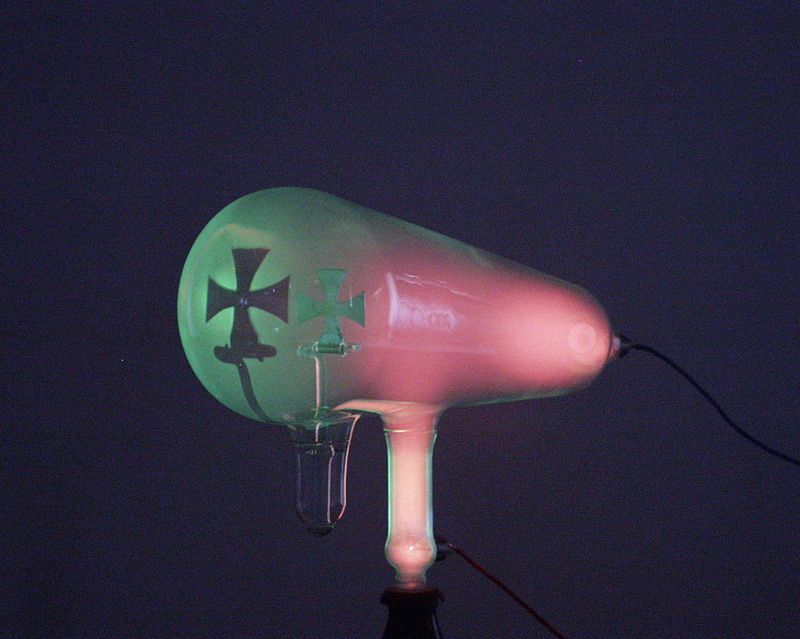
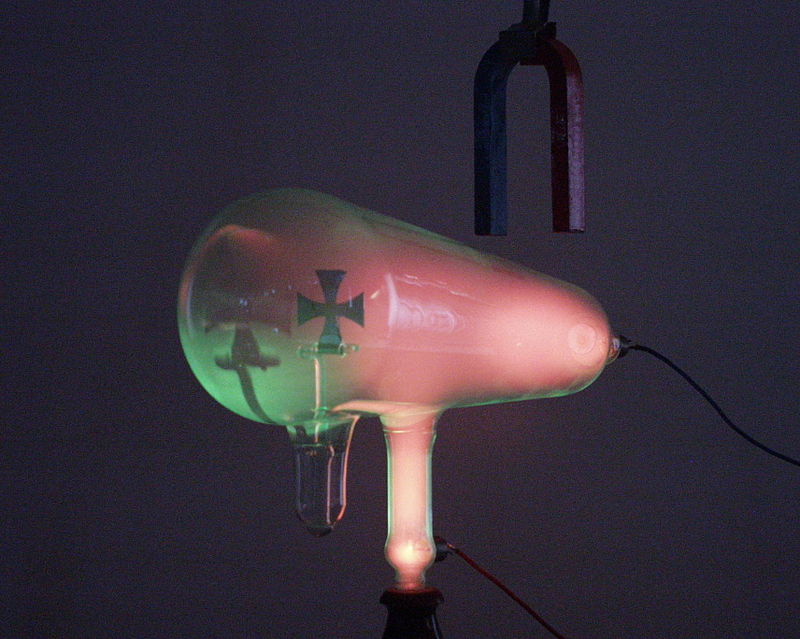
- En definitiva, los rayos catódicos tenían ciertas similitudes con los luminosos (los objetos interpuestos producían sombras, se propagaban en línea recta…), pero también diferencias: eran desviados por un campo magnético, mostrando que tenían carga eléctrica negativa, a diferencia de los rayos luminosos.
- Sobre el fenómeno de los rayos catódicos se planteó entonces, finales del s. XIX, una gran discrepancia entre las dos principales escuelas científicas de la época: por un lado, los físicos británicos y franceses (Davy, Perrin, Crookes, Thomson…) consideraban que los rayos catódicos eran un flujo de partículas electrificadas, inclinándose así por una explicación corpuscular; en cambio, la escuela alemana (Hertz, Lenard, Goldstein…) planteaba que los rayos se producían en el éter (un hipotético medio que supuestamente propagaba la luz) y diferían de la luz ordinaria ( y de los rayos X, descubiertos en 1895), pero eran ondas. En este contexto, J.J. Thomson comenzó una serie de experimentos destinados a resolver la controversia.
Nota: interpretación actual del fenómeno
- Cuando se aplica alta tensión al tubo, el campo eléctrico acelera el pequeño número de iones cargados eléctricamente siempre presentes en el gas, creados por procesos naturales; de esta forma, ocurren choques con otras moléculas del gas, extrayéndose nuevos electrones fuera de ellas y produciéndose más iones positivos (reacción en cadena denominada como descarga Townsend). Todos los iones positivos son atraídos al cátodo o electrodo negativo; cuando chocan con él, extraen a su vez un gran número de electrones de la superficie del metal, que se dirigen hacia el ánodo al ser repelidos por el cátodo, constituyendo los rayos catódicos.
- Si se ha bajado la presión lo suficiente, esto es, si se ha extraído suficiente gas del interior del tubo, la mayoría de los electrones puede recorrer la longitud del tubo sin chocar con una molécula de gas; la alta tensión acelera estas partículas con masa y, cuando llegan al ánodo en el extremo del tubo, tienen tanto impulso que, a pesar de la atracción del ánodo, lo sobrepasan y golpean la pared posterior, en el extremo del tubo. Cuando chocan contra los átomos del cristal, colisionan con sus electrones orbitales, excitándolos hacia un nivel de energía más alto; su desexcitación posterior da lugar a la emisión de luz, en un proceso de fluorescencia que hace brillar al vidrio, generalmente provocando un resplandor amarillo-verdoso (se puede incrementar pintando la pared trasera interior del tubo con productos químicos fluorescentes como el sulfuro de zinc, con el fin de hacer que el resplandor visible aumente). Después de chocar con la pared, los electrones eventualmente son atraídos de regreso al ánodo, donde un cable cierra el circuito hacia la fuente de alimentación.
Experimentos de Thomson
- A partir de 1896 J. J. Thomson, junto con J. S. Townsend y H. A. Wilson, llevó a cabo diversos experimentos que indicaron que los rayos catódicos eran realmente corpúsculos o partículas individuales, y no ondas, o partículas compuestas, como átomos o moléculas, según se había supuesto inicialmente. Thomson logró realizar buenas estimaciones tanto de la carga como de la masa, determinando que los «corpúsculos» de los rayos catódicos tendrían una masa alrededor de la milésima parte de la masa del ión hidrógeno y estableciendo que su relación carga-masa (e/m) era independiente del material del cátodo.
- En http://intercentres.edu.gva.es/iesleonardodavinci/fisica/Estructura_atomo/THOMSON_1936.pdf puede leerse un fragmento de la obra del propio Thomson «Recollections and Reflections», publicada en 1936 por George Bell, Londres, en que resume sus descubrimientos.
- Thomson hacía pasar los rayos catódicos por la combinación de un campo eléctrico y uno magnético, que ejercían fuerzas sobre los supuestos corpúsculos directamente proporcionales a la relación entre la carga y masa de ellos y, para la magnética, dependiente también de la velocidad. Los campos uniformes eléctrico E y magnético B se ajustaban para compensar mutuamente la deflexión ocasionada, de forma que, a partir del cociente entre los valores de los campos podía conocerse la velocidad y, adicionalmente, medir la relación entre la carga y la masa de las partículas involucradas:
; conocida la velocidad, retiraban el campo magnético y de la medida de la deflexión se obtenía la relación carga masa,
(véase http://teleformacion.edu.aytolacoruna.es/FISICA/document/teoria/A_Franco/elecmagnet/thomson/Thomson.html para el cálculo).
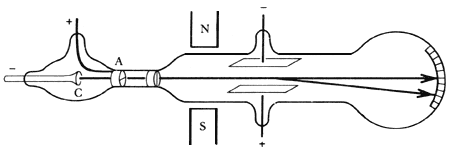
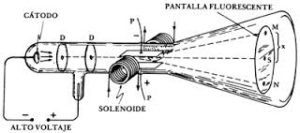
Tubo de rayos catódicos. Los electrones emitidos por el cátodo (C) son acelerados por el campo eléctrico hacia el ánodo (A) que deja pasar algunos por un orificio central. La trayectoria de este haz es afectada por la acción de un campo magnético y uno eléctrico. J.J. Thomson buscaba cancelar esos efectos para determinar la velocidad de los electrones. Fuente pie y figura: bibliotecadigital.ilce.edu.mx/sites/ciencia /volumen2/ciencia3/068/htm/sec_6.htm. - Los experimentos de J.J. Thomson y J. S. Townsend concluyeron pues:
-En 1894, que los rayos catódicos viajaban en línea recta y con velocidad muy inferior a la de la luz, lo que ponía a la hipótesis ondulatoria contra las cuerdas, porque una onda electromagnética debería propagarse a la velocidad de la luz.
-En 1897,que los rayos catódicos estaban formados por unos corpúsculos o «pequeños portadores», afirmando así su naturaleza corpuscular; el tamaño de los corpúsculos portadores de la carga debía ser pequeño en comparación con las dimensiones de los átomos o moléculas ordinarias, siendo los mismos para cualquier gas utilizado en el tubo de descarga.
-Que el valor de la relación carga/masa para los portadores era más de un millar de veces superior a la correspondiente al ión Hidrógeno (la relación carga/masa para este iónfue también determinada por Thomson), lo que indicaba que eran partículas muy livianas y/o muy cargadas: concluiría que su carga era del mismo valor absoluto que la del ión hidrógeno positivo, pero de signo opuesto, por lo que su masa tenía que ser mucho menor. (Nota: valor actual de la relación carga/masa para el electrón:
).
-Que los átomos no podían ser indivisibles, ya que de ellos se arrancaban partículas cargadas de electricidad negativa, que eran iguales entre sí en cuanto a la masa y la cantidad de carga de electricidad negativa, fuese la que fuera la especie de átomos de la que procedían, siendo por tanto elementos constitutivos de todo átomo.
-En 1899, lograrían medir su masa y carga por separado, siguiendo técnicas desarrolladas por Wilson, estableciendo que su masa sería unas 1800 veces menor que la masa del átomo de hidrógeno (alrededor de 1900 ya había determinaciones químicas de la masa del Hidrógeno que estimaban un valor de aproximadamente).
- Wilson mejoró el método de Thomson y Townsend, publicando resultados entre 1897 y 1903 que indicaban que la carga era del orden de
, lo que conducía a un valor para la masa electrónica del orden de
, de acuerdo con los cálculos de Thomson.
- Confirmada la existencia de los minúsculos portadores con carga eléctrica negativa y determinada su relación e/m, se adoptó para ellos el término de «electrones», que Stoney había introducido originariamente para las «unidades básicas de electricidad». Su descubrimiento tuvo como consecuencia la revisión del concepto de átomo como partícula fundamental e indivisible (etimológicamente «átomo» significa sin partes): se admitió que en su interior existían otras partículas más pequeñas.
Experimento de Millikan: determinación precisa de la carga del electrón
- La carga del electrón sería medida por primera vez con precisión aceptable por R. Millikan y H. Fletcher, en su famoso «experimento de la gota de aceite» de 1909, cuyos resultados se publicaron en 1911 y en el que usaban un campo eléctrico para frenar la caída en gravedad de una gota de aceite:
http://dieumsnh.qfb.umich.mx/fisquimica/millikan.htm
- Millikan determinó con una precisión del 1%, en 1910, que el electrón tenía una carga de
, muy próxima al valor aceptado hoy día (
).
- Una crítica a Millikan y su presentación de resultados: http://www.molesybits.es/2013/06/millikan-el-cocinero-de-resultados.html
Referencias
http://en.wikipedia.org/wiki/Crookes_tube
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/068/htm/sec_6.htm
http://intercentres.edu.gva.es/iesleonardodavinci/Fisica/Estructura_atomo/Estructura-atomo.pdf
http://web.educastur.princast.es/proyectos/fisquiweb/Videos/RayosCatodicos/IndexD.htm
http://dieumsnh.qfb.umich.mx/fisquimica/millikan.htm
[MEH-82] Mehra, J., Rechenberg, H.; The Historical Development of Quantum Mechanics, 6 vol., Springer-Verlag, Nueva York, 1982.
Páginas complementarias
http://www.sc.ehu.es/sbweb/fisica/elecmagnet/mov_campo/mov_campo.html
https://explorable.com/es/el-experimento-de-rayos-catodicos
http://www7.uc.cl/sw_educ/qda1106/CAP2/2A/2A2/
http://museovirtual.csic.es/coleccion/amaniel/radiactividad/radio4.htm
http://intercentres.edu.gva.es/iesleonardodavinci/Fisica/Estructura_atomo/Atomo1.htm
APPS:
Medida de la unidad fundamental de carga:
http://www.sc.ehu.es/sbweb/fisica/elecmagnet/millikan/millikan.html
Dejar una contestacion