Teorías atómicas primitivas
- En la tradición occidental, las primeras especulaciones sobre si la materia sería continua (infinitamente divisible) o discreta provienen de los antiguos filósofos griegos: en el s. V a.C. Leucipo y Demócrito postularon la materia constituida por unidades indivisibles, los «atomoi», supuestos inmutables; componiendo la materia en combinaciones de sus diferentes tipos, en movimiento; experimentando variaciones de posiciones que provocarían los cambios de estado observables en la Naturaleza… Un siglo después, Epicuro perfeccionaría esas ideas, desarrollando una gran teoría atomista en la que el azar liberaba a los hombres del determinismo de un destino inapelable, y con ello de los implacables dioses, regidores de ese destino según la pretensión de algunos. Para dar cabida al azar, los epicúreos consideraron el clinamen, en término latino del posterior epicúreo Lucrecio, año 50 a.C., consistente en una desviación espontánea de los átomos en su caída infinita en el vacío. La falta de experimentación que apoyara estas primitivas teorías, así como la oposición del gran filósofo Aristóteles a ellas, provocó su abandono durante casi dos mil años, hasta que en el s. XVII, como consecuencia de los trabajos de R. Boyle sobre el comportamiento de los gases, en los que concluyó su estructura corpuscular, la teoría atómica irrumpe de nuevo en la Historia, siendo aceptada, además de por Boyle, por científicos y filósofos como I. Newton, F. Bacon y R. Descartes. En 1738 D. Bernoulli publicó la obra Hydrodynamica, sentando las bases de la teoría cinética de los gases y postulando que los gases se componen de un gran número de moléculas, en continuo movimiento en todas direcciones. Otros, sin embargo, continuaron aferrados todavía a la idea de los cuatro elementos constituyentes: agua, tierra, aire, fuego; a ellos se añadió el flogisto, cuya pérdida en una sustancia inflamable explicaría su combustión, y cuya vida sería breve, al demostrar A. Lavoisier a finales del s. XVIII su arbitrariedad, tras un cuidadoso estudio de las variaciones de masa producidas en diversas reacciones físicas.
- En 1801 J.L. Proust formuló la ley de las proporciones definidas, la cual establece que, cuando elementos químicos se combinan para formar un compuesto dado, su razón en peso es siempre la misma; en 1807 J. Dalton enunció a su vez la ley de las proporciones múltiples, según la cual cuando dos elementos se combinan de diferentes maneras, dando lugar en correspondencia a diferentes compuestos, para un peso fijo de uno de ellos los pesos del otro, en los diferentes compuestos, guardan entre sí una relación de enteros. Estas leyes, así como los resultados previos de Lavoisier sobre las transformaciones químicas, serían explicadas por Dalton en 1808 en su obra «New System of Chemical Phylosophy», en la que presentó una teoría atómica en la que los átomos se establecen como los componentes primarios e indivisibles de la materia. Dalton suponía todos los átomos de un mismo elemento idénticos entre sí en tamaño, forma y peso; los átomos de diferentes elementos serían también diferentes entre sí; las reacciones químicas no producirían cambios en la naturaleza de los átomos, sino que sólo los recombinarían, siempre en razón simple.
- Establecidas las leyes de las transformaciones químicas, se podían establecer los pesos atómicos relativos. Originariamente, Dalton propuso una escala en se le asignó al Hidrógeno el valor 1; esta escala sería posteriormente sustituida por otra en la que al Oxígeno normal presente en la Naturaleza le era asignado el valor 16. En esta segunda escala, denominada como «escala química», el Hidrógeno poseerá un peso atómico 1,0079.
- También en 1808 J. Gay-Lussac demostró que las leyes de las proporciones definidas y múltiples eran también válidas para los gases, considerados en volúmenes, y postuló que todos los gases se dilataban en iguales proporciones en función del aumento de temperatura.
- En 1811, A. Avogadro formula su hipótesis: los gases están formados por moléculas compuestas por uno, dos, o más átomos, conteniendo iguales volúmenes de diferentes gases, bajo las mismas condiciones de presión y temperatura, el mismo número de moléculas; también, determinado número de moléculas de dos gases diferentes ocupa el mismo volumen, en idénticas condiciones de presión y temperatura. Una dificultad importante de la época era la confusión entre átomos y moléculas, y una de sus contribuciones fue clarificar su distinción, concibiendo que algunas moléculas podrían estar constituidas por dos o más átomos iguales. Su trabajo explicaría por qué cuando dos volúmenes de Hidrógeno se combinan con uno de Oxígeno, para producir dos volúmenes de agua, no hay divisiones de átomos de Oxígeno, ya que su molécula es diatómica. Además, según las leyes de Gay-Lussac, se implicaba que las sustancias que participaban en reacciones químicas lo hacían siempre de forma discreta. Avogadro utilizó su hipótesis fundamental para deducir la fórmula química de una serie de compuestos, para lo que utilizó como unidad de medida el mol, o número de gramos de un compuesto igual a su peso molecular (por ejemplo, un mol de agua pesa 18 gramos). El número de moléculas por mol, de acuerdo con Avogadro, es siempre el mismo, independientemente de la complejidad de la molécula, y a ese número se le denominó como «número de Avogadro«,
(él nunca llegaría a conocer una estimación de su magnitud, puesto que la primera se realizaría en 1865).
-Nota sobre terminología: Hoy en día, el mol ha sido adoptado como la unidad básica de la magnitud «cantidad de materia» en el Sistema Internacional de unidades, definiéndose como «la cantidad de una sustancia que contiene tantas unidades elementales de la misma (átomos, moléculas, iones, electrones…) como átomos hay ende carbono 12 (
) . Es decir, que contiene el número de Avogadro,
, unidades elementales. Denominaciones como «átomo-gramo», «molécula-gramo» y similares, están cayendo en desuso, a no ser en su contexto histórico.
- En 1815, la observación experimental de que muchos de los elementos conocidos poseían pesos atómicos, relativos al del hidrógeno, próximos a valores enteros, llevó a W. Prout a formular la hipótesis de que los átomos de todos los elementos estarían compuestos por átomos de Hidrógeno, idea que sería pronto desacreditada, conforme la precisión en la medida de pesos atómicos se iba mejorando, de forma que iba resultando evidente la existencia de pesos atómicos alejados de valores enteros.
- En 1833, los experimento de M. Faraday de electrólisis, con la formulación de las correspondientes leyes, evidenciaron una asociación entre la carga eléctrica y la estructura atómica. Dichas leyes pueden resumirse en la fórmula
, donde
es la masa de un compuesto dado, liberada en un electrodo cuando se hace pasar una corriente de carga eléctrica
a través de una disolución electrolítica (conductora);
es la constante de Faraday,
representa el peso equivalente de la sustancia, o peso atómico, o molecular, dividido por la valencia
(1 Faraday culombios libera 1,008 gramos de hidrógeno, 8 gramos de oxígeno -valencia 2-, etc. ). Faraday interpretó sus resultados suponiendo que una cantidad dada de electricidad era acarreada por cada átomo (o grupo de), denominándolos «iones»; en la electrólisis, la corriente eléctrica se producía al desplazarse estos iones a través de la disolución, los cationes (carga positiva) hacia el cátodo y los aniones (carga negativa) hacia el ánodo. Estos resultados implicaban la existencia de una unidad elemental de electricidad, de la cual algunos iones llevarían una unidad, otros dos… (nota: esta unidad valdría, según lo dicho,
, pero no se dispondría de estimaciones de
hasta 1865). Pero la idea de que la carga eléctrica existiese en unidades discretas contradecía otras evidencias experimentales, como las asociadas a la conducción metálica, y el mismo Faraday fue reacio a aceptarla.
- La hipótesis atómica sería ya plenamente aceptada durante la segunda mitad del s. XIX, cuando la Teoría Cinética de los gases se desarrolló, sobre todo gracias a los trabajos J.C. Maxwell, R. Clausius y L. Boltzmann (y su precursor D. Bernouilli, en el s. XVIII), fundadores de la Mecánica Estadística junto con J.W. Gibbs. La hipótesis atómico-molecular es la herramienta teórica básica que les permite explicar las propiedades de los gases, supuestos como constituidos por un gran número de partículas, «moléculas«, que realizan continuamente colisiones elásticas entre sí y contra las paredes del recipiente contenedor; todas son iguales entre sí para una sustancia dada y de pequeño tamaño frente a las distancias que separan unas de otras; la temperatura absoluta
del gas es proporcional a la energía media de las moléculas. Entre otros éxitos, la Teoría Cinética logró explicar el fenómeno del movimiento aleatorio de pequeñas partículas suspendidas en un fluido, descubierto por R. Brown en 1827: se debería a las colisiones de las moléculas del fluido con las partículas en suspensión. Sin embargo, sus éxitos no impedirían que fuera ignorada en un principio.
- En 1860 S. Cannizzaro llevó a cabo un trabajo sobre la determinación de pesos atómicos y una reformulación de las ideas de Avogadro, logrando que se aceptaran las ideas de éste y aumentara el número de partidarios de las teorías atómicas en Química.
- En 1865 J. Loschmidt realizó una primera estimación del número de Avogadro, estimando el diámetro medio de las moléculas en el aire a partir del cálculo del número de partículas en un volumen determinado de gas (ésta sería la estimación que usaría Stoney para obtener un primer valor de la unidad elemental de carga que sugerían las leyes de Faraday). En 1907, por su parte, J. Perrin, a partir de observaciones sobre el movimiento browniano antes referido, realizaría una nueva estimación, obteniendo ya un valor próximo al moderno. También fue él quien propuso denominar como «de Avogadro» al número de átomos en un mol de hidrógeno, más tarde redefinido como el número de átomos en 12 gramos del isótopo carbono 12: recuérdese que, con esta segunda definición, la masa en gramos de un mol de átomos de un elemento es igual al peso atómico en unidades de masa atómica de dicho elemento; en cualquier gas, a 1 atmósfera de presión y 0° C de temperatura, 22,4 litros contienen este número de moléculas.
-Nota histórico-terminológica: originalmente el nombre de «número de Avogadro» refería al número de moléculas en una molécula-gramo de oxígeno; la denominación «constante de Avogadro» aparece cuando se introduce el mol como una unidad básica de la magnitud «cantidad de sustancia» del Sistema Internacional de Unidades (SI), en 1971. El número de Avogadro es pues una magnitud adimensional que tiene el valor numérico de la constante de Avogadro, la cual posee unidades de; la constante de Avogadro entonces ya no es un número puro, sino una magnitud física:
.
- Conforme se fueron determinando los pesos atómicos de muchos elementos, se fue poniendo de manifiesto una relación entre estos pesos y las propiedades químicas. En 1869, D. Mendeleev llevó a cabo una ordenación de todos los elementos conocidos hasta entonces, en orden creciente de pesos atómicos. La manifiesta periodicidad de sus propiedades le permitió clasificarlos en 8 grupos, siendo uno de los éxitos más importantes de su tabla periódica el que los huecos que dejó, que debían ser ocupados por elementos desconocidos en el momento de su elaboración, pero cuyas propiedades quedaban predichas por la posición del hueco, fueron ocupados efectivamente por nuevos elementos descubiertos posteriormente (por ejemplo, escandio, galio, germanio). La tabla periódica de los elementos, resistente al paso del tiempo, fue la primera evidencia consistente sobre la similaridad en estructura entre átomos de diferentes elementos.
Desarrollo de la Espectroscopía
- El estudio de la luz emitida y absorbida por los átomos es una de las principales fuentes de información sobre ellos, de tal manera que la Espectroscopía puede considerarse en justicia como un antecedente de la Física Atómica. Pues bien, simultáneamente a los progresos anteriores, los conocimientos espectroscópicos iban ampliándose en una rápida cadena de nuevas observaciones, cuyo origen suele situarse en el descubrimiento por I. Newton, en 1666, de que la luz solar se descomponía en colores al atravesar un prisma.
- Se denomina como espectro de una radiación, de una intensidad dada, a su composición en frecuencias (o, equivalentemente, longitudes de onda). La Espectroscopía analiza la radiación de cualquier rango de frecuencias, de forma que, además de Espectroscopía de luz visible, se habla de Espectroscopía de rayos X, de rayos gamma, etc. Su objetivo primario es obtener información acerca del cuerpo emisor de la radiación, por ejemplo, su estructura interna o temperatura, su composición, etc. En particular, la denominada Espectroscopia analítica identifica átomos o moléculas por medio de sus espectros.
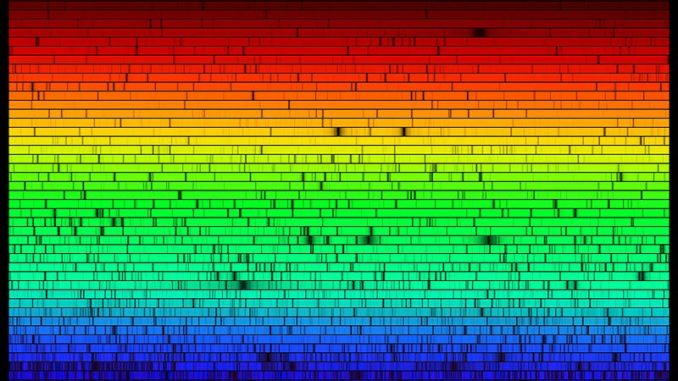
- En 1802 W. H. Wollaston (1766-1828) perfeccionó el experimento de la descomposición de la luz solar de Newton, instalando una rendija estrecha en la trayectoria de un rayo de luz solar y descubriendo así unas siete líneas oscuras entre los colores del espectro solar, pero sería J. von Fraunhofer quien, en 1814, utilizando una instrumentación mucho más sofisticada, haría público el primer espectro solar, presentando observaciones de un gran número de líneas oscuras, casi 600, conocidas desde entonces como «líneas de Fraunhofer«, correspondientes a la absorción de algunas frecuencias aisladas o discretas de un fondo continuo de radiación:
Líneas oscuras de Fraunhofer (fuente: NASA). - Cuando un gas o vapor atómico, a presión menor que la atmosférica, es convenientemente excitado, la radiación emitida contiene tan sólo ciertas longitudes de onda, características del elemento en cuestión. Un esquema básico para analizar esta radiación consistiría en un tubo de descarga lleno del correspondiente gas, usualmente monoatómico, a través del cual se hace pasar una descarga eléctrica. Debido tanto a las mutuas colisiones de los átomos como a sus colisiones con los electrones, algunos átomos se excitan, es decir, adquieren un estado de energía superior; cuando regresan a su estado inicial, se deshacen del exceso de energía emitiendo radiación electromagnética. Si se colima esta radiación con una rendija, y se le hace atravesar el dispositivo adecuado (un prisma en siglos pasados, una red de difracción modernamente), la radiación se separa en sus frecuencias constituyentes, dando lugar al registro (por ejemplo, sobre una placa fotográfica, o en un archivo digital, etc.) del correspondiente espectro de emisión.
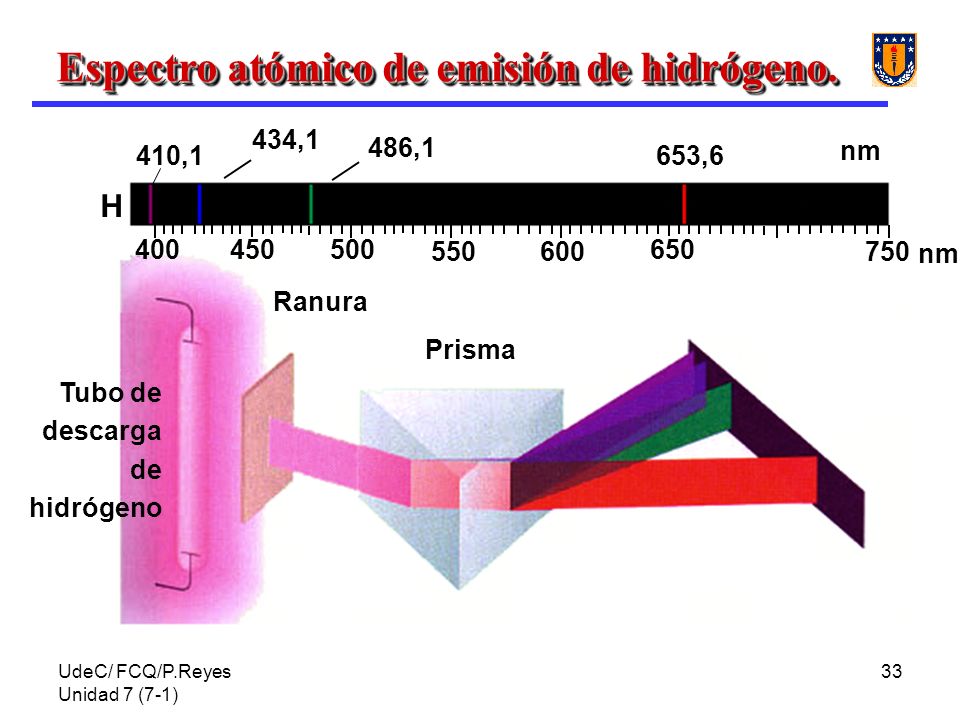
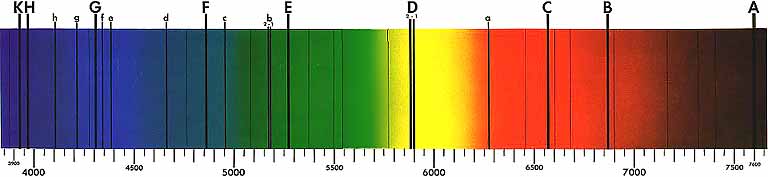
Autoría de la imagen: images.slide.player.es; P. Reyes, Fac. de Químicas, Univ. de Concepción. - Las figuras siguientes nos ilustran el típico aspecto que presenta un espectro de líneas, tanto de emisión (líneas brillantes sobre un fondo oscuro) como de absorción (líneas oscuras sobre un fondo continuo):

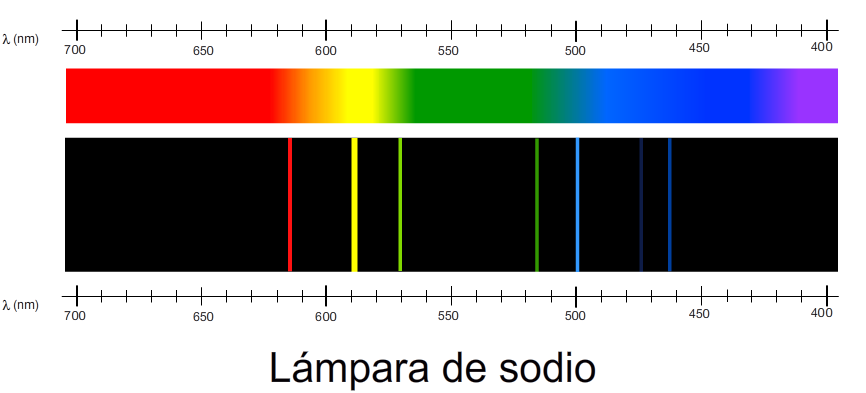

-Nota sobre el espectro del Sodio: El espectro de emisión del Sodio contiene un brillante «doblete», integrado por dos líneas D muy próximas, con valores respectivos de longitud de ondade
y
nanómetros. La línea a
tiene dos veces la intensidad de la línea a
.
- J. Plücker, a mediados del s. XIX, obtuvo los espectros de varios gases mediante este procedimiento de efectuar descargas eléctricas en tubos de vacío (ver entrada rayos catódicos), siendo el primero en reconocer que dichos espectros eran característicos del gas atómico contenido en el tubo y estableciendo como resultado de sus trabajos que las líneas C y F de Fraunhofer se debían al Hidrógeno.
-

Llama de Cu. En 1752 T. Meville había mostrado que, añadiendo sal marina a un mechero de alcohol, la llama se volvía amarilla; este hecho marcó el desarrollo de la llamada «espectroscopía de llama», en la que a partir de las primeras observaciones con espectroscopio por W.H.F. Talbot, en 1826, se publicaron espectros de emisión, compuestos de líneas discretas muy brillantes, en lugar de las líneas oscuras de los espectros de absorción de Fraunhofer.
-Numerosos físicos, como J. Herschel, Wheatstone y Foucault, realizaron estudios sobre los espectros de las llamas. En 1859, G. Kirchoff y R.W. Bunsen demostrarían que cada una de estas líneas estaba asociada con un elemento químico, de manera que el espectro de ‘Fraunhofer» podía servir para determinar la composición química de la atmósfera del Sol; a partir de entonces las observaciones espectroscópicas se multiplicaron, observándose líneas semejantes en el espectro de numerosas estrellas. La figura siguiente ilustra cómo la presencia de determinadas rayas en el espectro solar indica la presencia de Hidrógeno y Sodio en su atmósfera: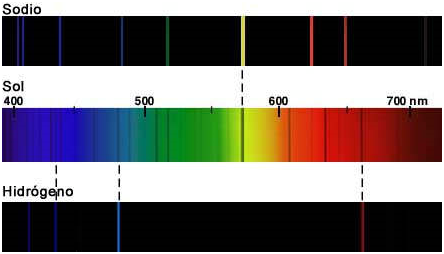
Imagen de: https://bpombo.wordpress.com/category/astronomia/page/3/ -Algunas de las líneas observadas por Fraunhofer, sin embargo, no se originaban en la atmósfera solar, sino en la terrestre. Así, las líneas A y B estaban ocasionadas por la absorción del oxígeno molecular de nuestra atmósfera:

Imagen: C.A Aya y E.J. Guio, Univ. F.J. de Caldas. - Bunsen observó las llamas producidas por diversas sustancias a través de prismas y los resultados le permitieron establecer que las líneas brillantes emitidas por vapores metálicos incandescentes son independientes de la temperatura, así como de los elementos con los cuales esos metales están combinados, ofreciendo características constantes y fijas de los elementos químicos, y ello aunque estén presentes en cantidades mínimas. Entre 1860 y 1861, estas ideas de análisis espectral por emisión le permitieron descubrir el Rubidio y el Cesio.
- En 1859 Kirchhoff concibió la idea de producir artificialmente en el laboratorio las líneas de Fraunhofer; para ello, encendió una intensa llama generadora de las dos líneas amarillas del Sodio y en el trayecto colocó una lámpara de alcohol con una solución de sales de Sodio. Instantáneamente, las líneas amarillas y brillantes se convirtieron en las líneas oscuras D, idénticas a las del espectro solar; si en lugar de sales de Sodio utilizaba cloruro de Litio, era la línea roja característica del Litio la que se tornaba oscura. Reconoció entonces que las llamas coloreadas, fuentes de líneas brillantes, si están colocadas entre una fuente luminosa bastante intensa y el prisma absorben los rayos de la misma longitud de onda que emiten, introduciendo en el espectro rayas negras en su lugar. Las líneas oscuras D en el espectro solar permiten, por tanto, concluir que se encuentra Sodio en la atmósfera solar. A raíz de sus experimentos, Kirchhoff enunció sus leyes espectroscópicas, que pueden enunciarse:
- Un sólido o un líquido (o un gas muy denso) incandescente produce siempre un espectro continuo.
- Un gas (enrarecido) incandescente produce un espectro de líneas brillantes de emisión, sin continuo.
- La observación de un espectro continuo a través de un gas lo transforma en un espectro con líneas oscuras.
- Las posiciones de las líneas tanto de emisión como de absorción son características de la constitución química de la materia que las produce: cada elemento y cada compuesto tiene sus líneas características. Los elementos absorben o emiten luz sólo de ciertas longitudes de onda; en consecuencia, el estudio de un espectro permite la identificación de los elementos químicos que lo produjeron.
-La siguiente imagen ilustra estos resultados: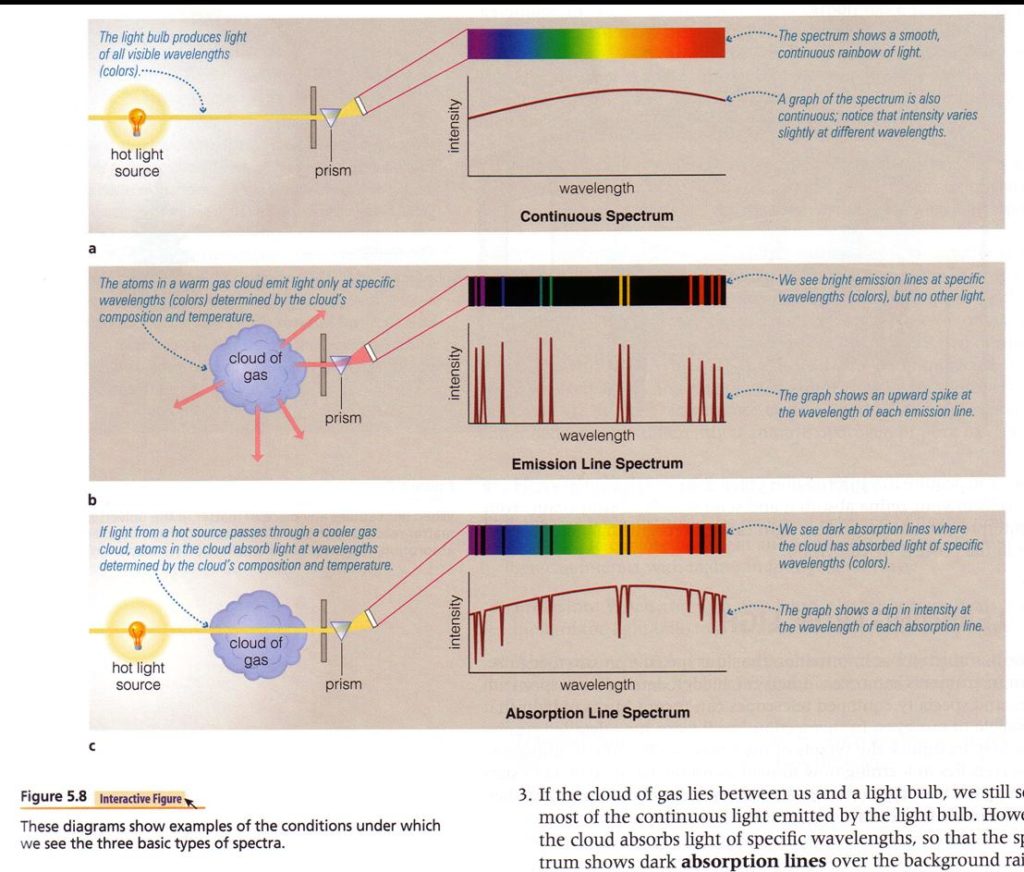 (Fuente principal párrafo e imagen: presentación de José Maza Sancho, profesor del Observatorio Astronómico Nacional Cerro Calán, Universidad de Chile).
(Fuente principal párrafo e imagen: presentación de José Maza Sancho, profesor del Observatorio Astronómico Nacional Cerro Calán, Universidad de Chile).
- En definitiva: la materia en fase condensada (líquidos y sólidos) emite radiación, a cualquier temperatura, pero la naturaleza de esa radiación se debe a la colectividad de un gran número de átomos que interaccionan entre sí, de forma que presenta un espectro continuo y no proporciona información característica de los átomos individuales. Por el contrario, los átomos y moléculas en un gas enrarecido están tan alejados unos de otros en promedio que sus únicas interacciones mutuas ocurren en colisiones aisladas, de forma que la radiación emitida es característica de cada átomo o molécula individual presente. Un elemento dado sólo puede absorber o emitir unas frecuencias dadas, características. Sin embargo, aunque todas las líneas del espectro de absorción aparecen en el de emisión, la recíproca aparentemente no se cumple en muchas observaciones, debido a que la temperatura no es suficiente para que los átomos se encuentren en los requeridos estados excitados (si se aumenta la temperatura del gas, se recuperaran esas antes ausentes líneas en el espectro de absorción).
- Las siguiente figura muestra espectros característicos de ciertos elementos:
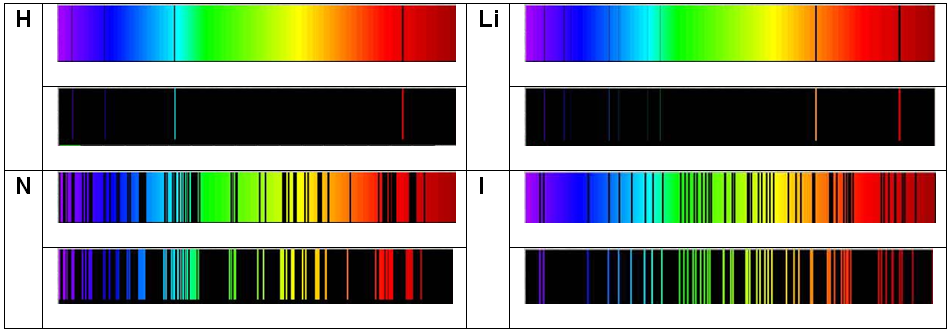
Fuente de la imagen: http://datateca.unad.edu.co/contenidos/401582 /ContenidoLinea/leccin_5_espectros_atmicos_y_modelo_atmico_de_bohr.html.
- El número, anchura y posición de las líneas en el espectro de un elemento dependen de la presencia o no de campos eléctricos y magnéticos, y del movimiento de la fuente (y, el que aparezcan algunas o no, de la temperatura). A partir del análisis del espectro, es posible no sólo identificar el elemento que está presente en la fuente de la radiación, sino también obtener información sobre su estado físico. Por ejemplo, un astrónomo puede establecer a partir del espectro de una estrella tanto los elementos presentes en su atmósfera como si éstos están ionizados o no, si la estrella se desplaza acercándose o alejándose de la Tierra, etc.
- Un enlace donde admirar numerosos espectros, a elección:
https://atomic-spectra.net/spectrum.php - El espectro de un gas o vapor molecular excitado, por su parte, consta de unas bandas, constituidas por paquetes de líneas muy próximas entre sí, estando su origen en las rotaciones y excitaciones de los átomos:

Imagen: I.N. Manik, Univ. Northern, Bangladesh.
Regularidades numéricas en los espectros
- El primer descubrimiento de una regularidad numérica en un espectro atómico fue hecho por W.N. Hartley en 1883, al encontrar en el espectro del zinc que los intervalos entre líneas en varios tripletes, o grupos de tres líneas muy juntas, eran los mismos cuando las líneas se caracterizaban por su número de ondas,
.
- En 1885, J.J. Balmer encontró una fórmula sencilla que relacionaba las longitudes de onda de una serie de líneas del espectro visible del Hidrógeno atómico,
, donde
es una constante de valor ajustado a
y
un entero, con valores
.
- La fórmula fue pronto extendida hasta
y expresada como
,
, siendo
la constante de Rydberg para el Hidrógeno, en número de ondas, de valor
(valor experimental actual), siendo conocida como fórmula de Balmer; las correspondientes líneas constituyen la serie de Balmer, o serie en el visible del espectro del átomo de Hidrógeno.

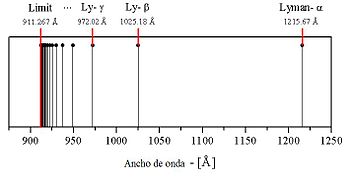
- La fórmula sería después aplicada al ultravioleta por Lyman (
), y al infrarrojo por Paschen (
). Finalmente, Rydberg la generalizaría como la expresión
,
, aplicándola también a la representación de las series de líneas encontradas en los espectros de los alcalinos.
- A partir de la fórmula de Rydberg, para cada valor fijo de
, los sucesivos valores enteros
generan lo valores de las correspondientes series de líneas, denominadas según (¡tomar el n en la figura como el m de la anterior fórmula!):

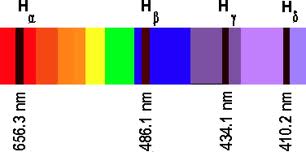
- Dentro de cada serie, las sucesivas líneas se suelen notar usando el alfabeto griego: por ejemplo, para la serie de Balmer las sucesivas líneas se notan como
,
,
, etc., en valores decrecientes de
(
,
,
para la serie de Lyman, etc.). Por ejemplo, la línea
de la serie de Balmer no es sino la línea C de Fraunhofer, una intensa línea roja de
.
- Las cantidades
se denominan «términos espectrales», y Rydberg demostró que para otros átomos, en particular para los alcalinos, las frecuencias de las líneas pueden expresarse también como diferencias de términos generalizados
,
, donde
era una constante, distinta para cada serie.
- En 1908, toda la información disponible pudo estructurarse con la formulación por W. Ritz de su principio de combinación, empírico, que establece que: 1) Las frecuencias (o número de ondas) de todas las líneas espectrales pueden representarse como diferencias de términos (de expresión a veces más complicadas que las anteriores), y 2) Si en un espectro existen líneas con números de ondas respectivos
y
,
,
, entonces aparecerá muy probablemente también la línea de número de ondas
, teniéndose
(ciertas combinaciones no se observarán, debido a determinadas reglas de selección que operan).
- Todos estos resultados representaban un desafío a la teoría física, un test que todo nuevo desarrollo teórico debía confrontar en términos explicativos.
Referencias
Páginas complementarias:
https://riubu.ubu.es/bitstream/handle/10259.3/64/22.0_Trabajo_con_vidrio.pdf
Dejar una contestacion